EL CONTROL DE HPV

Nombre: SOCIEDAD ESPAÑOLA DE CITOLOGÍA
Dirección: Calle Canarias, 38, 1º H, 28045 Madrid
Teléfono: 984 051 604
Email: secretaria@secitologia.org
Acreditación ISO/IEC 17043:2023: Nº19/PPI026 de fecha 07/02/2025
COMITÉ PARA EL PROGRAMA QPap DE CONTROL DE CALIDAD DE LA SOCIEDAD ESPAÑOLA CITOLOGÍA
Dr. Francesc Alameda Quitllet
Director del Programa de Control Calidad de la SEC.
Dra. Belén Lloveras Rubio
Coordinadora del Programa de Control de Calidad de la SEC.
Dr. Antonio Martínez Lorente
Responsable del Programa de Control de Calidad de la SEC.
Dr. Francesc Tresserra Casas
Vocal del Programa de Control Calidad de la SEC.
Dr. John Comba
Vocal del Programa de Control Calidad de la SEC.
Dª. Miriam Castella Rufat
Secretaria Técnica del Programa de Control Calidad de la SEC.
SECRETARÍA TÉCNICA DEL PROGRAMA QPap DE CONTROL DE CALIDAD
Secretaria Técnica: Dª. Miriam Castella Rufat
Dirección: Hospital Universitari Quirón Dexeus. Barcelona
Teléfono: 932 274 714
Email: calidad@secitologia.org

Producto: programa de intercomparación para evaluar la eficacia del diagnóstico en el cribado del cáncer de cérvix uterino en muestras cérvico-vaginales obtenidas mediante citología líquida.
- Tipo resultados esperados: programa cualitativo;
- Frecuencia: continua (dos rondas/año);
- Formato de distribución: simultánea;
- Proceso: analítico;
- Método de determinación de valores asignados: consenso de un grupo de participantes competentes;
- Criterios de evaluación del desempeño: por juicio de expertos o mandato reglamentario (es decir, un valor prescrito);.
Método de ensayo (Q-Pap molecular): pool de casos concentrados y homogéneos (ítems) a partir de muestras citológicas obtenidas y preservadas en base líquida, con resultado previo conocido de HPV negativo y positivo alto riesgo incluyendo los genotipos de alto riesgo 16 y 18, y otros, mediante pruebas de detección del ADN y pruebas de detección de ARNm E6/E7. Se pretende analizar la capacidad diagnóstica reproduciendo la práctica habitual, distanciándose de diagnósticos no usuales, (damos categoría a los genotipos con capacidad oncogénica más frecuentes en nuestro medio) como se presupone en un programa de control de calidad de cribado.
Parámetro: nivel de concordancia de las distintas variables entre el valor asignado (valor de referencia) y el valor emitido (respuesta de un participante).
Intervalo de trabajo: un año natural (ajustado a los distintos programas de cribado para el cáncer cervical en muestras cérvico-vaginales procesadas mediante citología líquida).
Condiciones del ensayo: aquellas que se realizan en práctica habitual.
Programa de la medición externa de la Calidad (External Quality Assessment EQA): la mayor parte de los programas EQA son programas continuos que incluyen un seguimiento a largo plazo del desempeño. Una característica típica de los programas EQA es que instruyen a los participantes y promueven la mejora de la calidad. Las recomendaciones y comentarios educativos constituyen parte del informe que se entrega a los participantes para lograr este fin.
La Comisión del PCC-SEC garantiza la confidencialidad de los resultados de los participantes. Si la SEC es requerida por ley a revelar información confidencial acerca de un participante, la SEC deberá cumplir la ley (LOPD, art 8, apartados 1 y 2, de 5 de Diciembre de 2018), informando previamente al participante.

Calendario del Programa de Control de Calidad de Diagnóstico de determinación de HPV QPap Molecular

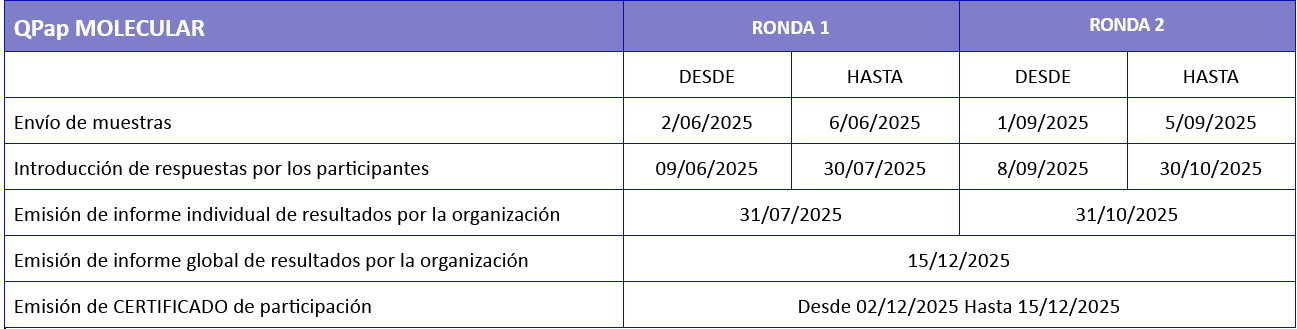

Se incluyen un total de 8 alícuotas provenientes de toma de citología ginecológica en medio líquido, repartidas en cada una de las rondas: 4 muestras por ronda. Las muestras están contenidas en viales de 4 µl con medio citolyt ThinPrep.
Los materiales de ensayo se enviarán a los laboratorios participantes en las fechas indicadas en el calendario del programa. El envío se realizará por mensajería en condiciones de embalaje, almacenamiento e identificación de acuerdo a los requerimientos de IATA sin necesidad de adoptar condiciones especiales. Se sugiere conservar las muestras recibidas a temperatura estable y sin exceso de luz antes de su procesamiento.
Se ruega confirmación de recepción de las alícuotas en estado adecuado para su análisis, mediante correo electrónico a Calidad@secitologia.es

Servicio de Anatomía Patológica de Hospital de Barbastro, actúa en el ejercicio 2025 como centro colaborador y experto. Se encuentra acreditado por UNE-EN ISO 15189 para el alcance: “detección del Virus del Papiloma Humano para genotipos de alto riesgo”. Se encargó de elaborar cuatro pooles de casos, a partir de muestras obtenidas en medio líquido, con resultado previo conocido de HPV positivo alto riesgo incluyendo los genotipos 16, 18, o negativos. El programa molecular está dirigido tanto a determinación de DNA como RNA viral. Una vez realizados los pooles, se comprobó de nuevo el resultado de cada uno de ellos y posteriormente se alicuotaron.
La primera y la segunda alícuotas de cada una de los pooles que constituyen el programa, fue remitida por el Laboratorio de Biología Molecular del Hospital de Barbastro al Servicio de Anatomía Patológica del Hospital del Mar (Laboratorio de biología molecular), centro que actúa como experto y se encuentra, también, acreditado por UNE-EN ISO 15189 para el alcance: Test de VPH alto riesgo – Detección molecular y genotipado (HPV 16-18). Los resultados de ambos servicios expertos deben ser 100% concordantes. Asimismo el Laboratorio de Biologia Molecular del Hospital del Mar, ha testado las alícuotas remitidas (Numero 2), con un segundo método de detección de HPV (Allyplex)
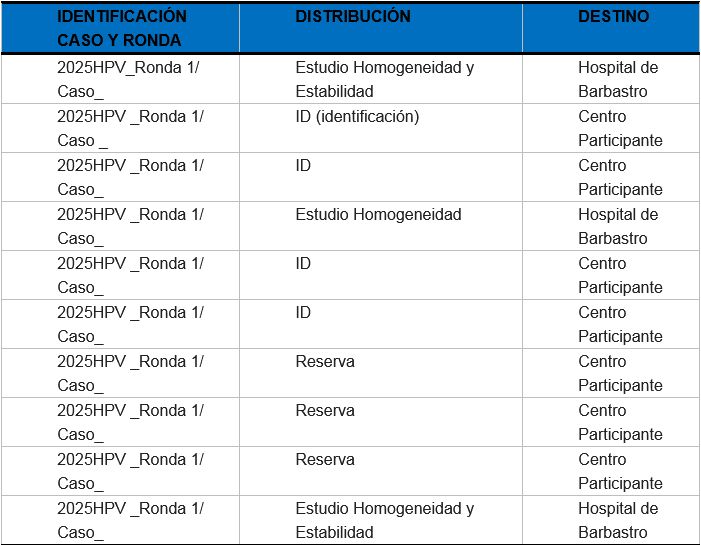
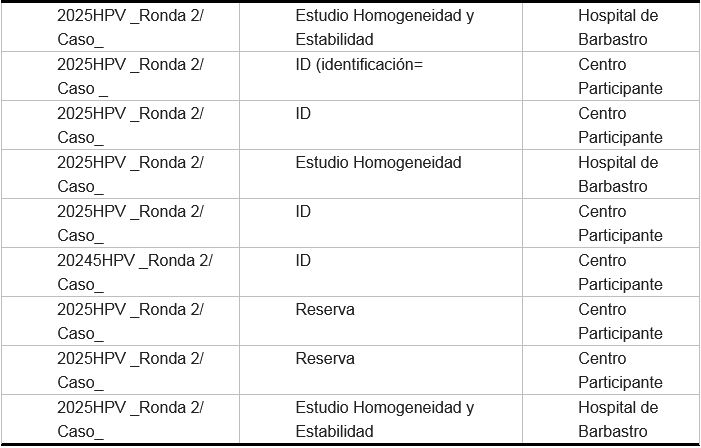
Para el Programa de control de calidad QPap Molecular2025 se han incluido un total de 8 muestras de citología ginecológica en medio líquido, repartidas en cada una de las rondas: 4 muestras por ronda. Las muestras están contenidas en viales de 4 μl con medio citolyt ThinPrep.
La cantidad de muestras (alícuotas) a preparar, por pool y para cada ronda, viene determinada por la siguiente ecuación:
N+H+E+R
N: número de participantes en la ronda
H: número de muestras para homogeneidad (H=3)
E: número de muestras para estabilidad (E=2)
R: número de muestras de reserva (10% respecto del total de participantes)

Se determina según instrucciones de la norma ISO/IEC 17043:2023 identificadas en los apartados siguientes:
7.3.2.5 Se debe demostrar que los ítems del ensayo de aptitud son suficientemente estables para asegurarse de que no sufrirán cambios significativos a lo largo de la realización de la ronda de EA, incluyendo las condiciones de almacenamiento y transporte. Cuando esto no sea posible, se debe cuantificar la estabilidad y considerarla como una componente de la incertidumbre asociada al valor asignado del ítem de EA y/o tomada en cuenta en los criterios de evaluación.
7.3.2.6 Cuando se retienen los ítems del EA de rondas anteriores para su uso en otra ronda de EA, el proveedor de EA debe confirmar, antes de la distribución, los valores de la propiedad o las características a determinar en el programa de EA.
En función del número total de muestras se seleccionan para el estudio de homogeneidad y estabilidad una muestra del mismo volumen y características.
Se establece como norma la temporalidad desde la recepción de la muestra hasta la comunicación del resultado, correspondiendo a un periodo de dos meses. De este modo, se toma una muestra al inicio, una a mitad y otra al final, garantizando que el resultado sea el mismo en todos los periodos medidos.
Todos los resultados son canalizados y registrados por la secretaría técnica del Programa

Valor asignado: se determina según instrucciones de la norma ISO/IEC 17043:2023 en Anexo B Apartado B.3.5: “para programas de Ensayos de Aptitud (EA) cualitativos e interpretativos, hay varias opciones para deducir el valor asignado:
- Por juicio de expertos;
- Mediante el uso de materiales de referencia como ítems de EA;
- A partir del conocimiento del origen o producción de los ítems de EA;
- Usando la moda o la mediana de los resultados de los participantes (la mediana no es apropiada para valores nominales”.
Apartado B.3.7: cuando se realiza un análisis estadístico de los resultados de los participantes para determinar un valor asignado o un criterio de desempeño, los proveedores de EA deben tener:
- Procedimientos para tratar los resultados extremos, a los que se hace referencia como errores graves y valores atípicos;
- Procedimientos estadísticos detallados para calcular la media y la desviación estándar de los datos de los participantes, apropiados para los objetivos del programa de EA y el número de participantes; estos incluyen pasos para comprobar que las hipótesis estadísticas sean razonables…
Nivel de incertidumbre: se calcula atendiendo a las indicaciones de la ISO/IEC Guía 98-3:2008:
“Además, en muchas aplicaciones industriales y comerciales, así como en las áreas de la salud y de la seguridad, a menudo es necesario proporcionar un intervalo en torno al resultado de la medición, en el que se espera encontrar la mayor parte de valores de la distribución que pueden ser razonablemente atribuidos a la magnitud objeto de la medición. Por tanto, el método ideal para evaluar y expresar la incertidumbre de medida debería ser capaz de proporcionar fácilmente un intervalo, en particular, aquel con la probabilidad o el nivel de confianza que corresponda de manera realista con lo requerido”.

Los resultados deben introducirse a través del área privada de cada Centro/Institución participante y publicadas en la plataforma de formación online SmartZoom ClassRoom https://sec.smartzoom.com/,
Los participantes deben expresar sus diagnósticos con dos categorías:
- POSITIVO GENOTIPOS 16,18 ALTO RIESGO
- NEGATIVO GENOTIPOS 16,18 ALTO RIESGO
Las respuestas de los participantes son descargadas en una hoja de cálculo para realizar la evaluación y el tratamiento estadístico.
Las respuestas deben ser de carácter individual, obtenidas exclusivamente en el laboratorio que ha procesado las muestras.
Una vez finalizado el plazo máximo indicado en el calendario, la ronda se cerrará y no se podrán incluir resultados.
Todo el proceso cumple con las garantías de privacidad y protección de datos.

FUNDAMENTO
El diagnóstico de una enfermedad se enmarca dentro de un proceso general de toma de decisiones y es un proceso dinámico que nos permite trabajar en términos de probabilidades hacia la confirmación o no de una enfermedad. Bajo la denominación de pruebas diagnósticas se engloban las pruebas utilizadas para la detección precoz de enfermedades y las pruebas confirmatorias, que deben cumplir requisitos distintos en función de su utilidad.
Si dispusiéramos de pruebas perfectas no habría incertidumbre, pero la realidad es que todas las pruebas llevan algún grado de error que hay que conocer y asumir. Una buena prueba es aquella que resulta normal en los individuos sanos y anormal en los enfermos y las características que debe tener una prueba son validez, fiabilidad y seguridad, es decir, que mida lo que realmente pretende, que sea reproducible produciendo resultados semejantes y que pueda predecir la presencia o ausencia de enfermedad (5).
En ocasiones interesa conocer los resultados de una prueba comparando la probabilidad de obtener un resultado en un individuo con enfermedad y sin enfermedad. Para ello se utiliza el cociente de probabilidad estos índices no dependen de esa proporción de enfermos en la muestra.
Validez
Sensibilidad (S): probabilidad de que un enfermo sea identificado correctamente por la prueba, es decir, que tenga una prueba positiva. Son los enfermos con prueba positiva de entre todos los enfermos.
Especificidad (E): probabilidad de que un individuo sin la enfermedad sea identificado correctamente por la prueba, es decir, que tenga una prueba negativa. Son los sanos con prueba negativa de entre todos los sanos.
Proporción de falsos negativos: probabilidad de que un enfermo sea identificado incorrectamente por la prueba y obtenga una prueba negativa. Son los enfermos con prueba negativa de entre todos los enfermos
Proporción de falsos positivos: probabilidad de que un individuo sin la enfermedad sea identificado incorrectamente por la prueba, es decir, que tenga una prueba positiva. Son los sanos con prueba positiva de entre todos los sanos.
Seguridad
Valor Predictivo Positivo (VPP): probabilidad de que un individuo con prueba positiva tenga la enfermedad. Corresponde a los enfermos con pruebas positivas de entre todas las pruebas positivas.
Valor Predictivo Negativo (VPN): probabilidad de que un individuo con prueba negativa no tenga la enfermedad, es decir, que esté realmente sano. Corresponde a los pacientes sanos con prueba negativa de entre todas las pruebas negativas.
Razones de probabilidad
Cociente de probabilidades positivo (CP+): también conocido como cociente de verosimilitud (likelihood ratio of positive test). Se calcula dividiendo la proporción de enfermos con prueba positiva entre la proporción de no enfermos con prueba positiva. Valores mayores de CP+ indican mejor capacidad para diagnosticar la presencia de enfermedad.
Cociente de probabilidades negativo (CP-): se calcula dividiendo la proporción de enfermos con prueba negativa entre la proporción de no enfermos con prueba negativa. Vemos que valores de CP- menores indican una mejor capacidad diagnóstica de la prueba.
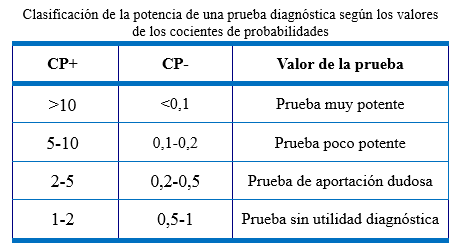
Utilidad: sensibilidad y especificidad son propiedades intrínsecas a una prueba diagnóstica que indican su capacidad para clasificar correctamente enfermos y sanos.
Por su parte, los valores predictivos nos informan de la probabilidad de que un positivo esté enfermo o de que un negativo esté sano, aunque su valor depende de la prevalencia de la enfermedad en la población en que se calcula.
Los cocientes de probabilidades nos ayudan a calcular la probabilidad real de padecer la enfermedad conociendo la probabilidad previa y el resultado de la prueba.

Resultados por ronda
- Rango de resultados globales
- Nº de participantes aceptados para el cálculo estadístico
- Valores asignados e incertidumbre
- Desviación estándar del ejercicio
- Evaluación del desempeño del participante
- Recomendaciones atendiendo a los resultados del participante
CONTENIDO DEL INFORME ANUAL DEL PROGRAMA

Incluirá:
- Introducción
- Definiciones
- Datos generales del proveedor y del programa
- Calendario
- Determinación del valor asignado y su incertidumbre
- Confidencialidad, protección de datos y cumplimiento de principios éticos
- Estadística empleada
- Datos generales del Ejercicio 2024
- Datos específicos del programa Q-Pap Molecular
- Centros participantes, número de inscritos y tasas de respuesta
- Concordancia respecto al valor asignado y su incertidumbre
- Preparación de muestras
- Valor asignado
- Discordancia según parámetro de riesgo para las distintas categorías diagnósticas
- Determinación del valor diagnóstico de la prueba molecular de HPV en los programas de cribado poblacional
- Sensibilidad
- Especificidad
- Proporción de falsos negativos
- Proporción de falsos positivos
- Valor predictivo positivo
- Valor predictivo negativo
- Cociente de probabilidades positivo
- Cociente de probabilidades negativo
- Discusión y conclusiones
- Cuadro de indicadores para la determinación del valor diagnóstico de la citología en los programas de cribado cervical
- Bibliografía consultada
- Índice de tablas, gráficas y figuras
- ANEXOS

Toda la información relativa a los participantes inscritos en el Programa de Control de Calidad de Citología Ginecológica de la SEC será tratada con total confidencialidad, incluyendo la evaluación obtenida y no se revelará a terceras partes salvo autorización explícita del participante para un fin concreto.
La Sociedad Española de Citología (SEC) se compromete a mantener durante todo el programa de intercomparación los requisitos de la norma UNE-EN ISO/IEC 17043:2023. Del mismo modo, la SEC se compromete a respetar los principios éticos básicos en relación a las muestras biológicas utilizadas, siempre provenientes de imágenes de diagnósticos ya emitidos e incorporados en las historias clínicas de las pacientes, así como las normas establecidas por la Ley Orgánica 3/2018, del 5 de diciembre, de Protección de Datos Personales y de Garantía de los Derechos Digitales, que adapta la legislación española al Reglamento General de Protección de Datos de la Unión Europea (RGPD), en relación a los participantes e instituciones que forman parte del programa.

 Una vez ha finalizado la participación en el Programa de ese año (2 rondas anuales), el participante o la Institución pueden solicitar el Certificado de Participación en el PCC-SEC.
Una vez ha finalizado la participación en el Programa de ese año (2 rondas anuales), el participante o la Institución pueden solicitar el Certificado de Participación en el PCC-SEC.
El certificado únicamente puede emitirse cuando se ha participado y completado los resultados en las 2 rondas del PCC-SEC y aplica tanto a QPap Morfológico como a QPap Molecular

Se recuerda a los participantes que los materiales enviados por el Programa de Control de Calidad de SEC, en este caso alícuotas para la determinación de HPV, deben ser evaluadas como si se tratara de práctica habitual.
Al finalizar el programa, y una vez se ha emitido el informe global del ejercicio, se pedirá la colaboración de los participantes para responder a una encuesta de satisfacción, que rogamos contesten.
No dude en contactar con nosotros ante cualquier incidencia: calidad@secitologia.org.
Gracias por su participación.
